百蔬君:请关注CRISPR-Cas9基因编辑技术,CRISPR-Cas9的易用性和低费用已经可以让更多大众参与到基因改造项目中来。利用此项技术治愈单基因突变引起的疾病,比如白血病,艾滋病,但是对于多基因控制的疾病可能无能为力,设想如果改变了一个人成百上千个基因,谁都没有办法预料可能会发生什么了,更何况一些致病基因本来就是另外一种基本的抗性基因,比如删掉CCR5基因可以免疫艾滋病病毒,但死于西尼罗河病毒的风险高上13倍,改造FUT2基因可能降低患I型糖尿病的概率,但也增加了感染诺瓦克病毒的风险。另外如果改造人类的生殖细胞,那么这将会遗传给子孙,这些修改基因将代代相传,人类的遗传就已经不是原本的那么一回事了。富人可以用基因编辑技术增加智商,肌肉强化,延迟衰老,美容塑身,或许在不久的将来,这些可能都不仅仅是只出现在科幻电影里面了,而是迅速走到人们的面前,因为"我们能"。
文章一:我们到底能用基因编辑做些什么?
(Allison Liu/译)”曾经的天方夜谭已变得触手可及。”在华盛顿特区一个关于人类基因编辑的历史性峰会上,加州理工学院的大卫·巴尔提摩(David Baltimore)说,”改变人类遗传的技术已近在眼前,我们需要决定,我们的社会该怎样运用这种能力。”
基因编辑从未如此简单又如此强大,值此契机,三个国家的顶尖科研机构举办了这个为期三天的峰会,为科学家、伦理学家、律师以及对此感兴趣的公众提供了一个”思考基因组编辑对科学和社会的影响”的机会。这是1975年在加州阿西洛马举办的一场类似会议的精神的延续。在那次会议中,参会代表讨论了初生的基因工程技术的伦理学问题。
巴尔提摩参与了这两次会议,据他所说,情况已与当时大不一样。区别就在于人们现在掌握了一系列改变人类DNA的新工具,尤其是风靡的CRISPR-Cas9系统,它让科学家可以轻易地删除、修改或插入基因。相较以往,新技术更加经济、精确,也更加全能:就像计算机之于算盘——或者换个更黑化的场景——就像机关枪之于长矛般天差地别。

CRISPR-Cas9系统已经成为目前最方便的基因编辑工具。图片来源:origene.com
到了必须讨论它的时候了
由于我们掌控了这种力量,一些老生常谈——比如扮演上帝、定制婴儿或者《美丽新世界》中敌托邦式的遗传有产者和无产者(编者注:在《美丽新世界》中,利用遗传技术,人类从胚胎期就被分为五个阶级,长大后”各司其职”,从事不同性质的职业和活动)——又成了眼前亟待解决的问题。无论是试管婴儿、克隆、干细胞治疗、还是线粒体置换疗法,每当新一波基因技术出现,这些问题就要老调重弹一次——但也有人说现在正是讨论的最佳时机。”在过去,对这些可能性,科学家们可以轻易地不予理会。”弗朗西斯·科瑞克研究所的罗宾·洛弗尔-巴吉(Robin Lovell-Badge)说,”但很快,我们就无法再否认这些问题了。”
这个转折点发生在4月,中山大学黄军就的团队称他们利用CRISPR编辑了人类胚胎(实验使用的是无法存活、无法发育成人类个体的胚胎),对能导致遗传病”β-地中海贫血”的缺陷基因进行了改造。这项研究让全世界措手不及。在美国,这类研究是无法进行的,至少使用联邦经费时绝不可能;在英国,如果获取了许可,可以研究胚龄在14天内的胚胎。
对此,一些科学家呼吁,在人们能够评估CRISPR和其他基因编辑手段的安全性、探讨这些技术的社会影响,并制定出明确的伦理学规范和管理条例前,暂时中止任何对人类生殖系进行基因编辑的研究。
这个峰会也因而举办。然而,参会代表在第一天就花了大量时间争执一个更微妙的问题:即使我们能够安全又精确地编辑人类基因,但又为什么要这么做呢?
为什么我们需要基因编辑?
如果考虑在人体中进行基因编辑,那么最显而易见的应用就是治疗疾病。一个月前,医生利用基因编辑治愈了一例无法治疗的白血病——他们先取出患病女孩的免疫细胞,对其进行编辑,让这些细胞既能杀死癌细胞又能耐受化疗药物,再将之注入患者体内。其他团队正在尝试取出艾滋病患者身上的细胞,删去一个特定基因——艾滋病病毒通过这个基因编码的蛋白进入细胞,再将之注回患者体内。这些案例被称为体细胞治疗,改造的都是生在人类体内、和人类共存亡的细胞。
对人类生殖系基因(也就是精子、卵细胞和早期胚胎细胞的基因)进行编辑就要有争议得多了。这种改造影响的不仅仅是单独的个体,还会影响他们的子孙后代。这些改变世代相传,可能会改变人类的遗传轨道。
生殖系改造最能派上用场的地方在于治疗一些严重的遗传病,比如囊肿性纤维化、亨廷顿舞蹈症或者戴萨克斯症。这些遗传病都会造成使人衰弱的症状,预后情况都很不理想,而且都是由单基因突变导致的。在一个基因编辑安全有效的时代,这些疾病完全可以预防。
“我是一名母亲,我的孩子死于胎儿先天缺陷。”美国组织库协会(American Association of Tissue Banks)的萨拉·格蕾(Sarah Gray)对一群专家组成员说,”他只有六天大,却无时无刻不深陷折磨。他每日都会发作癫痫。如果你们有技术有能力治愈这些疾病,那就该死地付诸行动。”
而其他一些常见病,如阿兹海默症、糖尿病和一些癌症,受成百上千个基因调控。对于这种情况,基因编辑就只能降低患病风险,而不能完全预防疾病。
也许最受争议的是,人类可以利用CRISPR和其他基因编辑技术进行非治疗性的人体强化,比如通过改造基因来增加肌肉质量、身高或智力。人们所熟悉的关于定制婴儿的抵制就是这样回来的。
首选之策?
以上是大局,现在说说一些细节。
考虑一下一些严重的遗传病,比如戴萨克斯症或者亨廷顿舞蹈症。对于显性遗传病来说(单拷贝的缺陷基因就能致病),有50%的胚胎是正常的;对于隐性遗传病(双拷贝缺陷基因才会致病),有75%的胚胎正常。所以大部分情况,人们并不需要基因编辑。父母可以选择进行体外受精,随后由医生筛选出未携带风险基因的胚胎。这项技术——胚胎植入前遗传学诊断(PGD)——只有在父母双方都携带致病基因,且所有胚胎都会受到影响时才会失效,但这样的情况非常罕见。
“如果真要避免遗传病,生殖系基因编辑对我们来说既非首要选择,也非次要选择,甚至连第三第四选择都谈不上。”布罗德研究所的埃里克·兰德(Eric Lander)说。实际上,更为有效的办法是推广遗传学诊断测试,让父母们意识到自己是风险基因的携带者,从而进行胚胎植入前遗传学诊断。
但植入前遗传学诊断也不是万能药。哈佛大学医学院的乔治·戴利(George Daley)治疗了一些NEMO缺陷综合征患儿,基因缺陷导致他们的免疫系统异常衰弱。患儿家属常常会再生一个健康的孩子,用他/她的骨髓来挽救自己的哥哥或姐姐。植入前遗传学诊断看起来是个显而易见的解决方案,但那个时候父母往往已经年岁较大,这种方法的成功率变得很低。去年,戴利的同事在8个家庭中尝试了这项技术,尽管平均每个家庭尝试了5次体外受精,仅有一家生出了宝宝。这种情况下,戴利说,与其像买彩票般寄希望于生出健康宝宝,不如干脆利落地用CRISPR技术对某个胚胎进行基因编辑。
技术的双刃
哈佛大学的CRISPR先驱——乔治·丘奇(George Church)认为在某些合法用途中也可能藏有灰色地带。”我认为有些人可能会借治疗严重疾病的名义进行基因强化。”他说。比如,因老年痴呆导致身体功能减退的患者可能会求助于基因编辑,抑制认知功能下降。”接下来是有老年痴呆高风险但年纪尚轻的人,再接下来是想占据先机、继而又想修复自身精子的商业大亨。”
但基因编辑在常见病的治疗上可能毫无用武之地,因为这些病往往受大量基因调控。比如说,如果想要治疗精神分裂症风险最高的人群,你可能需要利用CRISPR编辑数千个基因来将他们的患病率降低到平均水平。这可不是个好主意,原因会在下文中说明。
这同样适用于其他方面,比如智力、身高、运动能力或个性,这些属性都受数千个基因影响;除此之外,环境因素也起着重要作用。”这并不是一加一等于二那么简单。”约翰·霍普金斯大学的医学史学家纳撒尼尔·康福特(Nathaniel Comfort)写到,”如果你相信有可能定制婴儿,那么你低估了基因调控机制的复杂性。
所以,无论我们能多么精确地编辑基因,有些东西也不是我们能一编了之的,更别提安全性了。很少有功能单一的基因。编辑数千种基因会让身体陷入难以预料的境地。比如说,删掉CCR5基因可以让人们免疫艾滋病病毒,但也让他们死于西尼罗河病毒的风险高上13倍。改造FUT2基因可能降低患I型糖尿病的概率,但也增加了感染诺瓦克病毒的风险。
即使是严重疾病背后的基因也可能拥有预计不到的功能。导致镰刀型贫血病的基因型能在人类中流传下来,是因为这种基因能够帮助携带者抵御疟疾。将这种基因变体从人类基因库中除去也许并不是什么好主意。
“我能想出的适用于基因编辑的对象,一只手就能数出来。”兰德说。比如,E4型的ApoE基因携带者更容易患老年痴呆症。你可以编辑这个基因,兰德说,”但我可不敢保证不会出问题,因为大概3%的人类保留了ApoE4基因。”这让他有些犹豫,”如果(编辑这个基因)是个好主意,为什么它没在演化过程中被淘汰呢?”他问道。
问题在于,有些人根本不会在意这些问题。”在一定程度上,新技术的应用都来自需要,但我们也不应忘记,它们同时也受市场需求驱使。”戴利说。当运用和滥用CRISPR同样容易,一些黑诊所就可能会提供基因编辑服务以进行人体强化——即使科学家认为这些技术不安全、无效,甚至只是空谈。毕竟,吹得天花乱坠的维生素补剂能激起购买热潮,未经证实又缺乏监管的干细胞疗法亦是如此——如果这些案例给我们了一个启示,那就是”为什么要运用这项技术?”这个问题的答案很可能只是:”因为我们能。”
文章题图:spectrumnews.org
作者:Ed Yong 著名科普作家,大西洋月刊科学专栏撰稿人
(文章来源:果壳网)
文章二:CRISPR-Cas9新一代基因编辑技术获得专利权
我们什么?4月15日,隶属于麻省理工学院和哈佛大学的世界著名生物医学研究机构Broad研究所宣布,美国专利局批准了由他们所申请的基于CRISPR-Cas9系统的基因编辑技术专利。这是目前世界第一例获得专利保护的基于CRISPR-Cas9系统的基因编辑技术。

正在生物体内发挥功能的CRISPR-Cas9系统。插画家:Stephen Dixon
所谓基因编辑技术,是指对DNA核苷酸序列进行删除和插入等操作,换句话说,基因编辑技术使得人们可以依靠自己的意愿改写DNA这本由脱氧核苷酸写而成的生命之书。然而长期以来,对DNA的编辑只能通过物理和化学诱变、同源重组等方式来对DNA进行编辑。然而这些方法要么编辑位置随机,要么需要花费大量人力物力进行操作。因此,能够方便而精确的对DNA和核苷酸序列进行编辑,是科研工作者们长期以来的梦想。CRISPR-Cas9系统的诞生和成熟标志这这一梦想逐渐变为现实。此外不仅仅在科研界,在诸如医疗、农业、畜牧业等研究中,这一技术也显现除了巨大的应用前景。因此,这一技术获得专利,是该技术走向应用的里程碑式事件。
从细菌免疫系统到DNA编辑工具
CRISPR-Cas9系统并非天生就是为人类使用而产生的。它的本质其实是细菌中一种对付诸如病毒等外来DNA的防御系统。在一些细菌基因组中存在一系列成簇排列的DNA序列,被称作”规律间隔成簇短回文重复序列”(Clustered Regularly Interspaced Short Palindromic Repeats,CRISPR)。这些重复序列的间隔序列,被发现和很多能够侵入细菌的噬菌体DNA序列相同。进一步研究发现,这些序列在被转录成为RNA后,能够和细菌产生的一类称为Cas的蛋白质形成复合体,来对Cas蛋白起到导向作用,因此这段RNA也被称为导向RNA(guide RNA,gRNA)。当复合体检测到入侵的DNA和gRNA序列一致时,Cas蛋白就能够切割入侵的DNA,达到防御的目的。
注:严格来说,在细菌体内gRNA由两部分组成:一部分为活化Cas蛋白所需的tracrRNA,另一部分为来自于间隔区、识别入侵DNA的crRNA。在人工构建的CRISPR-Cas9系统载体中,这两段RNA可融合为一条。
CRISPR-Cas系统这种序列特异性的DNA切割机制很快引起了人们的兴趣。由于这一系统能够切割DNA,并且其序列特异性由crRNA的序列所决定,因此它成为了DNA编辑的理想工具。细菌中的CRISPR-Cas系统极为多样,而一个来自产脓链球菌(Streptococcus pyogenes)的由Cas9蛋白参与的系统被人们研究的最为透彻。因此人们对它进行了改造,将编码Cas9蛋白的序列及其附属元件共同制造成为一个单一的载体。同时为了能够让这些组分进入真核细胞的细胞核,还加入了入核信号元件。这样一来,只要科研人员只需针对需要编辑的DNA序列合成一段DNA序列,插入这个载体的特定部位。在转入宿主细胞后,产生的人工构建的gRNA就能指导Cas9蛋白切割宿主细胞特定的DNA序列,从而起到基因编辑的作用。
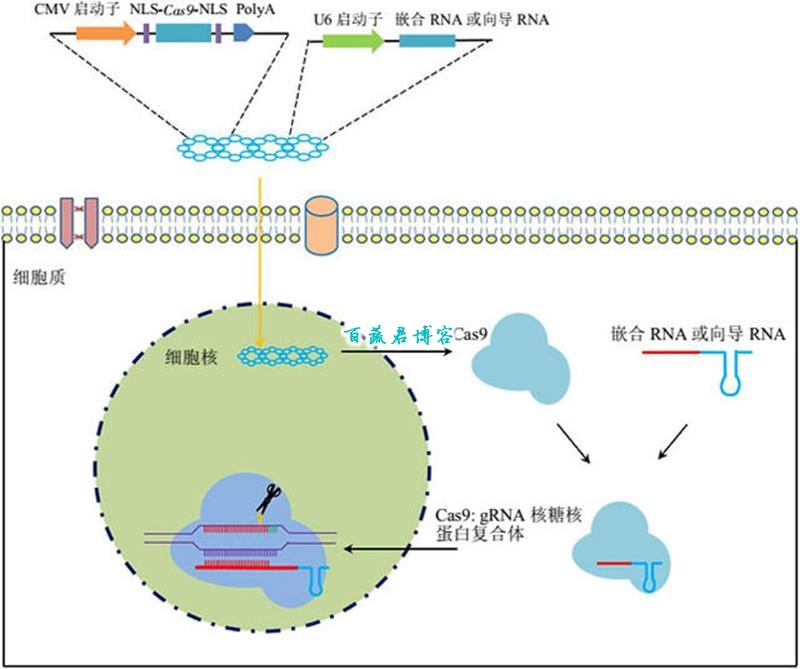
CRISPR-Cas9基因编辑系统示意。图片来源:《生物化学与生物物理进展》
DNA编辑的广泛前景
CRISPR-Cas9系统,被称为第三代基因编辑技术。相比于它的两位前辈ZFN系统和TALEN系统,它有着一些无可比拟的优点。首先,CRISPR-Cas9系统的可用位置更多。理论上基因组中每8个碱基就能找到一个可以用CRISPR-Cas9进行编辑的位置,可以说这一技术能对任一基因进行操作,而TALEN和ZFN系统则在数百甚至上千个碱基中才能找到一个可用位点,这大大限制了使用范围。其次,CRISPR-Cas9系统更具有可拓展性,例如可以通过对Cas9蛋白的修饰,让它不切断DNA双链,而只是切开单链,这样可以大大降低切开双链后带来的非同源末端连接造成的染色体变异风险。此外还可以将Cas9蛋白连接其他功能蛋白,来在特定DNA序列上研究这些蛋白对细胞的影响。第三,更为重要的是,CRISPR-Cas9系统的使用极为方便,只需要简单的几步就能完成,几乎任何实验室都可以开展工作,而不需要向ZFN和TALEN那样借助商业公司的协助完成。由于以上特点,CRISPR-Cas9被评为2013年生物学10大突破之一。值得说明的是,CRISPR-Cas9系统在真核细胞中很多重要的研究,都是由华人学者张峰主持完成的。
由于来源于细菌的CRISPR-Cas9系统在真核细胞内也能很好的工作,这显示出了其巨大的应用潜力。例如在基础科学研究领域,CRISPR-Cas9系统最多的是被用来定点敲除一些基因,从而便于研究这些基因的生物学功能。同时CRISPR-Cas9系统的商业化应用潜力也不容小视。例如在生物治疗领域,结合诱导多能干细胞(iPS)技术,人们可以将通过基因编辑修复的iPS细胞重新发育为正常组织和器官来供病人使用。而在家畜育种等工作中,对一些关键性状基因的编辑能够大大加快良种的育种速度。
正是由于CRISPR-Cas9的诸多优秀特点和广泛的应用前景,因此它成为了专利申请的热门方面。尽管已经有多份应用CRISPR序列或Cas蛋白的技术专利,但这次Broad研究所获得批准的是第一份将一整套CRISPR-Cas9系统载体和操作方法包括在内的专利。这意味着今后使用这一技术进行基因编辑操作都将涉及这份专利所保护的内容。那么,专利的批准是否会妨碍这一技术的使用呢?目前来看,基础研究受到影响的可能性不大,因为Broad研究院的主任埃里克·兰德(Eric Lander)在专利宣布的新闻稿中表示:”考虑到Broad研究所的使命是为了加速我们对于疾病的理解和治疗,因此我们承诺授权给全球的研究团队使用这种技术的权利。”但是,在更有利可图的商业化应用领域,这一专利的出现是否会对使用该技术的企业造成影响还有待观察,毕竟Broad研究所在上述表态之外还有一句:”享有这一专利的限制权”。
参考资料
The Scientist: Patent Covers CRISPR
United States Patent: CRISPR-Cas systems and methods for altering expression of gene products
Zhang F et al. Multiplex Genome Engineering Using CRISPR/Cas Systems. (2013)Science 339(6121): 819-823
作者:fengfeixue0219 植物分子生物学博士
(文章来源:果壳网)
文章三:关于CRISPR基因编辑技术你必须知道的几件事情
各种基因编辑手段的涌现正悄然改变着医药行业和农业,并有可能改写人类族群的未来。


科学家和生物学家齐聚位于华盛顿的美国国家科学院(National Academy of Sciences)
过去的12个月是基因工程学大放异彩的时期。主要是因为一项名为CRISPR的新技术的诞生,这项技术使活体细胞DNA的编辑过程变得简单、低廉且十分精准。
本月初,数百名科学家和生物学家齐聚位于华盛顿的美国国家科学院,对CRISPR技术引起的争议性问题进行讨论:是否应当将此技术运用于修正人出生前的致病基因。
这种概念称为”胚系”编辑,因为其涉及精子、卵子或胚胎DNA的更改。
有一天,基因编辑将可能被用于阻隔某些可怕的基因遗传条件,如亨廷顿舞蹈病或肌肉萎缩症。
或者,正如一些反对者担忧的,基因编辑有可能使一大批蓝眼睛且超级聪明的婴儿降生。
但是基因工程婴儿并非全部,亦不是最重要的部分。人们应当意识到基因编辑技术在某些方面已经非常先进。
TR君决定对过去12个月的资讯进行整理,独家向读者提供以下几项人们需要了解的关于基因编辑的信息。
改写人类基因:TR在三月份时就带领读者了解了人类基因编辑的新兴科学,以及随之相伴的激烈讨论。如今,聚集在华盛顿的专家学者们又在讨论人类社会是否应至少在目前禁止将该技术运用于人体内。

在美国国家科学院举行的一次会议上,CRISPR基因编辑技术的发明者们就该技术是否应用于更改人类DNA这一问题进行了辩论
重塑动物:想知道基因编辑技术的能耐,只要看看科学家们将我们熟知的动物变成什么样了。已经接受基因改良的动物包括苍蝇、蠕虫、白鼬甚至是猎兔犬(在中国进行基因改造,变得十分强壮)。
一项值得引起关注的项目是初创公司动物生物科技公司(Recombinetics)对乳牛进行基因改造,使它们不长出牛角。该公司于上个月首次对以此方法产出的两头奶牛进行拍照。
工程植物:农业巨头争相涉足基因编辑领域,众所周知的原因之一是:缺乏监管。我们熟知的转基因作物——例如,具有除草剂抵抗力的玉米——需要经过昂贵的安全性测试和审批程序,因为它们带有细菌基因。
但如果科学家们坚持采用植物基因,基因编辑作物似乎也有可能在美国的监管规定下全身而退,正如他们确实创造了一种基因编辑马铃薯。杜邦公司(DuPont)是最大的转基因作物销售公司之一,认为首批基因编辑食物将会在五年内被端上餐桌。
专利之争:由于CRISPR基因编辑技术具有重造世界的潜力,对该技术真正发明者的归属出现激烈争抢便显得不足为奇。
争抢大战的其中一方是,加州大学伯克利分校,该校的生物学家詹妮弗·杜德纳(Jennifer Doudna)及其来自欧洲的同事们声称他们才是这项技术的发明者。
另一边则是,来自哈佛-麻省理工学院博德研究所(Broad Institute of MIT and Harvard)的张锋,他否定了上面的说法:他是第一个想到这项技术的人,且已经获得了将这些技术运用于人类细胞的专利。
伯克利分校已提请美国专利局(U.S. Patent Office)就CRISPR技术专利的真正归属进行裁决。
基因治疗:这方面的研究才刚刚起步,但随着对DNA结果进行更为精准调整的技术能力发展,将彻底改变基因治疗,即将健康有效的基因安入患有严重遗传性疾病(如血友病)的成人和儿童体内。
这是一种风险和难度都极高的医学技术,部分原因是需要用到病毒将新的DNA移入人体内。在美国,目前尚无任何基因治疗产品进入市场。
但基因编辑技术正通过扩充研究人员者工作时需用到的工具箱改变现状。因为这项技术使研究人员能更为精准地删除或修正以及增添基因。许多企业预测,两年内,GRISPR将会进行首次人体测试。
基础研究:CRISPR技术运用产生的最重要结果的关注却最少:对大学研究实验室的影响。
这项技术令许多实验更容易进行,并已经开始在癌症和自闭症的研究实验中采用。其中一个明显标志是:过去几年间关于CRISPR技术的出版物数量呈指数式增长。
生态影响:上个月,加利福尼亚州的生物学家创造出一种不仅能抵抗疟疾同时能将此抗性在蚊子种群中传播开来的蚊子。
这项技术名为”基因驱动”,这种技术方法能将基因编辑过的结构安入一种生物体内,通过繁衍传播特定DNA。
相关的研究人员希望通过释放此类蚊子终结疟疾传播,但许多人对此表示担忧。一旦释放此类蚊子,对物种造成的改变很难被撤销。
基因工程民主化:这是个令人夜不能寐的议题。CRISPR轻而易举便实现——你仅需花60美元在网上订购所需的成分——这让越来越多的科学家能掌握基因工程技术。
但下一轮的用户潮很可能是宅在家中的业余爱好者。今年,一种自己动手做的基因工程工具开发商开始以700美元的售价销售其产品,这甚至比某些电脑价格还低。
这种发展趋势有可能引发爆炸式创新潮——或危险且失控的新手试验。
当心!各位!
(来源百度百家,作者MIT Technology Review)
转载请注明:百蔬君 » 科学前沿:我们已经跨入大众改造转基因生物时代